L'énoncé
On réalise un titrage pH-métrique d’une solution d’ammoniac par de l’acide chlorhydrique.
Question 1
Quel est le matériel nécessaire à cette expérience ?
Une burette pour contenir l’espèce titrante, un bécher qui contient l’espèce titrée et un agitateur magnétique, un pH-mètre.
Question 2
Quelle est l’équation support de cette réaction ? Quelle est l’espèce titrante, quelle est l’espèce titrée ?
L’espèce titrante est l’acide chlorhydrique, l’espèce titrée est l’ammoniac.
$NH_3 + H^+ \longrightarrow NH_4^+$
Question 3
On trouve les résultats suivants :
|
V (mL) |
$0,0$ |
$6,0$ |
$10,0$ |
$14,0$ |
$14,5$ |
$14,7$ |
$14,9$ |
$15,1$ |
$15,3$ |
$15,5$ |
$15,7$ |
$16,0$ |
$18,0$ |
|
pH |
$10,69$ |
$9,38$ |
$8,90$ |
$8,05$ |
$7,74$ |
$7,51$ |
$7,03$ |
$4,40$ |
$3,93$ |
$3,71$ |
$3,57$ |
$3,40$ |
$2,95$ |
Données : $V_0 = 10,00$ mL d’ammoniac ; $C_0 = 1,0 \times 10^{-1}$ mol/L d’acide chlorhydrique.
Tracer au brouillon la courbe représentative du pH en fonction du volume d’acide chlorhydrique versé.
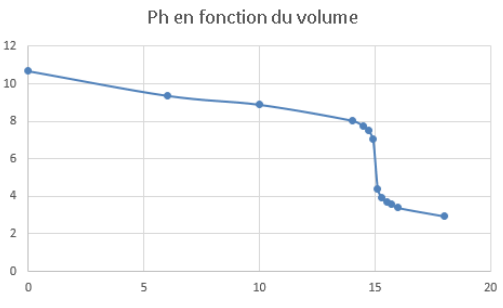
Question 4
Calculer la dérivée $\dfrac{dpH}{dV}$ pour les valeurs indiquées.
On obtient :
|
V(mL) |
$6,0$ |
$10,0$ |
$14,0$ |
$14,5$ |
$14,7$ |
$14,9$ |
$15,1$ |
$15,3$ |
$15,5$ |
$15,7$ |
$16,0$ |
$18,0$ |
| $\dfrac{dpH}{dV}$ |
$0,33$ |
$0,12$ |
$0,21$ |
$0,62$ |
$1,5$ |
$2,4$ |
$13,15$ |
$2,35$ |
$1,1$ |
$0,7$ |
$0,57$ |
$0,23$ |
Question 5
Tracer au brouillon la courbe représentative de $\dfrac{dpH}{dV}$ en fonction du volume d’acide chlorhydrique versé. Quel est ce volume à l’équivalence ?
Courbe représentative de $\dfrac{dpH}{dV}$ en fonction du volume d’acide chlorhydrique versé.
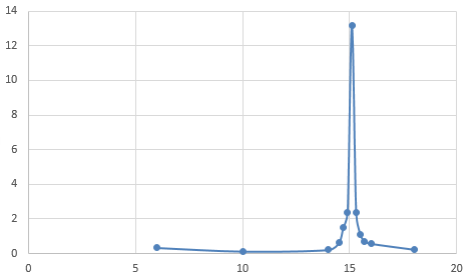
Le volume à l'équivalence est $15,1$ mL.
Question 6
Reproduire et compléter le tableau d’avancement suivant :
|
|
|
+ -> |
||
|
|
Avancement (mol) |
Quantité de matière d’ammoniac |
Quantité de matière apportée d’acide chlorhydrique |
Quantité produite de chlorure d’ammonium |
|
Etat initial |
$X = 0$ |
$n_1 =$ |
$n_2 =$ |
|
|
Etat intermédiaire 1 |
$X = x$ |
|
|
|
|
Etat final, équivalence |
$X = x_{eq}$ |
|
|
|
|
|
|
$NH_3$ + $H^+$ $\longrightarrow$ $NH_4^+$ |
||
|
|
Avancement (mol) |
Quantité de matière d’ammoniac |
Quantité de matière apportée d’acide chlorhydrique |
Quantité produite de chlorure d’ammonium |
|
Etat initial |
$X = 0$ |
$n_1 = C \times V$ |
$n_2$ |
$0$ |
|
Etat intermédiaire 1 |
$X = x$ |
$n_1 - x$ |
$n_2 - x$ |
$x$ |
|
Etat final, équivalence |
$X = x_{eq}$ |
$0$ |
$0$ |
$x_{eq}$ |
Question 7
En déduire la quantité de matière d’ammoniac présente dans la solution titrée.
Quantité de matière d’ammoniac présente dans la solution titrée :
À l'équivalence, on a : $n_{2eq} = n_{1eq} = x_{eq} = n_1 = n_2$.
Or, on a : $n_2 = C_0 \times V_{eq} = 1,0 \times 10^{-1} \times 15.1 \times 10^{-3} = 1.51 \times 10^{-3}$.
Donc : $n_1 =1.51 \times 10^{-3}$ moles.
