Fiche de cours
Titrage pH-métrique
I. Réaction de titrage
Le titrage pH-métrique est basé sur une réaction de titrage. Si on prend l’exemple d’une réaction entre un acide noté $AH$ et de la soude $NaOH.$ On ne s’intéresse qu’aux ions $HO^-$ pour la soude dans ce dosage. On va ajouter progressivement dans le milieu $HO^-$ pour doser l’acide qui est dans le milieu. On va suivre ce dosage à l’aide d’un pH-mètre.
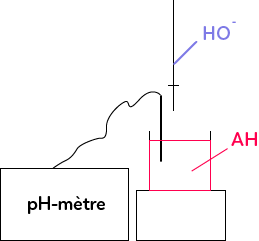
Quand on rajoute une goutte d’$HO^-$, les ions $HO^-$ réagissent instantanément avec $AH$ pour donner $A^-$ et $H_2O.$ Dans la première partie du dosage, on a seulement $AH,$ qui va diminuer progressivement.
II. Équivalence
Dès qu’on atteint l’équivalence, les espèces sont dans les proportions stœchiométriques. A l’équivalence, on a la formule : $\dfrac{n_{AH}}{1} = \dfrac{n_{HO^-}}{1}$. $n_{AH}$ initial $=n_{HO^-}$ ajouté. Tout l’acide présent dans la solution réagit. C’est la première
