Fiche de cours
Titrage par conductimétrie
I. Réaction de titrage
On prend l’exemple du dosage de la soude $NaOH$ par l’acide chlorhydrique $H_3O^+ + Cl^-.$
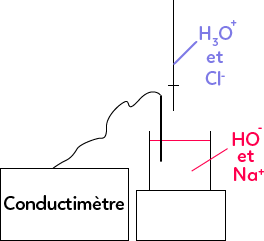
On essaie de déterminer la concentration inconnue des espèces présentes en solution ($Na^+$ et $HO^-$). Pour cela, on suit la réaction de dosage à l’aide d’un conductimètre. Et on ajoute goutte à goutte, millilitres par millilitres ou demi-millilitres par demi-millilitres, l’acide chlorhydrique. La réaction est la suivante :
$HO^-$ réagit avec $H_3O^+$ pour donner de l’eau. Cette réaction est rapide et totale, ce sont des paramètres importants. Lorsqu’on ajoute une goutte de $H_3O^+$ dans le milieu, les ions vont réagir avec $HO^-$ et donner de l’eau donc il reste dans le milieu un peu moins d’$HO^-$ qu’au début de l’expérience, un petit peu plus d’eau mais c’est le solvant, quelques ions $Cl^-$ qui ont été ajoutés en même temps que les ions $H_3O^+$. On
