Fiche de cours
Exercice : Acides et bases : jus de citron
ÉNONCÉ
En cuisine, le jus de citron est souvent utilisé pour camoufler l’odeur du poisson du plat. Cette odeur émanant du poisson est principalement due à la triméthylamine (CH3)3N qui est une amine très volatile. On sait que sous la forme acide cette amine n’est plus odorante.
Voici la formule de l’acide citrique :
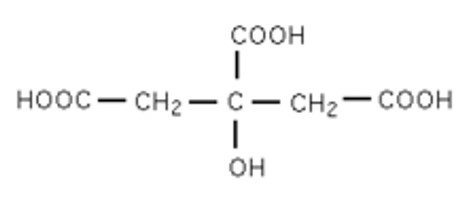
Le jus de citron contient environ 6 g d’acide citrique C6H8O7 (aq) pour 100 g de jus de citron. C’est un triacide.
QUESTIONS
1. Identifier les groupes caractéristiques de l’acide citrique et de la triméthylamine (CH3)3N.
2. Pourquoi cette dénomination de « triacide » ?
3. Donner les 3 couples A/B responsables issus de l’acide. Pour simplifier l'écriture, on note le triacide AH3.
4. Parmi ces espèces appartenant à ces couples certaines sont dites amphotères. Préciser lesquelles.
5. Justifier l’usage du jus de c
