Fiche de cours
I. Source de variation : le travail
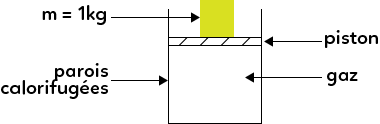
On prend l’exemple courant de la compression d’un piston. Les parois rectangulaires extérieures représentent le cylindre. Il est fermé par le piston, représenté en hachuré. Par-dessus, on a déposé une masse de 1 kg et à l’intérieur un gaz est emprisonné, il constitue notre système. Que se passe-t-il ?
Admettons que la masse d’un kilo ne soit pas présente, cela voudrait dire que le gaz à l’intérieur est dans le même état que celui à l’extérieur (pression, température). Que va-t-il se passer lorsqu’on appuie en mettant une masse de 1 kg dessus ?
Le gaz est comprimé, on le compresse. Par exemple, on fait l’expérience de prendre une pompe pour gonfler les pneus du vélo, si on bouche l’extrémité de la pompe c’est exactement comme si l’on mettait un piston. Maintenant si on appuie sur la pompe, c’est exactement comme si l’on mettait une masse. Sur le pouce à l’endroit où l’on bouche le trou, l’air est un peu plus chaud. Le système a tendance à chauffer lors de la compression.
Les équations nous rendent-elles compte de cet effet-là ?
Précisons que l’on suppose que les parois sont calorifugées. C’est-à-dire que de l’énergie, sous forme de chaleur, ne peut pas partir à travers les parois. Au niveau de la mise en équation, on commence par écrire ce qu’est le système ici. C’est le gaz qui est emprisonné.
On a alors : $ΔU = W + Q.$
Mais ici, comme les parois sont calorifugées on ne peut pas avoir d’échange de chaleur entre l’extérieur et le système. Il n’y a pas d’énergie apportée sous forme de chaleur.
Au final, on a $ΔU = W.$
Est-ce qu’on peut en déduire que la température va augmenter ? Oui, car on a vu dans d’autres cours sur les gaz que cette énergie interne elle est reliée à l’énergie cinétique macroscopique, celle-ci est liée à l’agitation des molécules qui composent le gaz. Cela signifie que si $ΔU > 0,$ l’énergie interne augmente et donc que l’énergie microscopique augmente. L’agitation des molécules augmentent et donc ça veut dire que la température de ce gaz est en train d’augmenter. Donc apporter un travail, avoir $W > 0$ induit que $ΔU > 0,$ et comme on vient de le dire, que la température augmente.
II. Source de variation : la quantité de chaleur
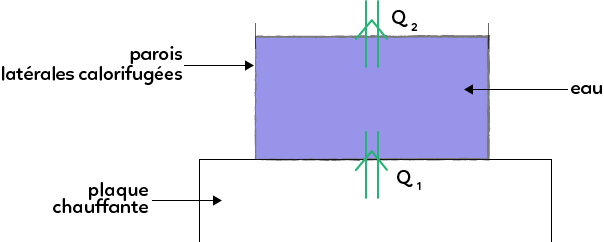
On prend un récipient avec de l’eau que l’on pose sur une plaque chauffante. On fait l’hypothèse que les parois latérales sont calorifugées.
L’énergie sous forme de chaleur ne peut pas partir sur les côtés. Par contre, l’énergie peut passer de la plaque chauffante à l’eau et on va dire que la chaleur, l’énergie qui passe s’appelle Q1. On suppose aussi que de l’énergie ressort au niveau de l’interface eau/air, on la note Q2. Le système c’est l’eau.
On a alors : $ΔU =W+Q_1 - Q_2$
Ici, il n’y a pas de travail mécanique, on ne vient pas compresser le liquide. Or pour un état condensé, on a aussi vu dans un autre cours qui concerne l’énergie interne et les états condensés, que $ΔU$ peut aussi s’exprimer comme cela :
$ ΔU =m_{eau} \times c_{eau} \times ΔT$.
On parle d’eau ici car le système c’est de l’eau. En égalisant ces deux équations portant sur l’énergie interne on peut isoler $ΔT$ et écrire que :
$ ΔT = \dfrac{Q_1-Q_2}{m_{eau} \times c_{eau}}$.
On suppose qu’on a mis un couvercle ce qui fait que l’on peut négliger la valeur de Q2 vis-à-vis de Q1.
Elle n’apparaît donc plus ici : $ΔT = \dfrac{Q_1}{m_{eau} \times c_{eau}}$.
N’oublions pas que Q1 est une énergie donc une puissance donc $Q_1 = P_1\times Δt$.
On a alors : $ΔT = \dfrac{P_1\times Δt }{m_{eau} \times c_{eau}}$.
$Δt$ étant le temps de chauffage.
Pour l’application numérique, on prend une plaque chauffante de 1000 W qui chauffe pendant 60 s. On prend une masse d’eau de 1 kg et la capacité thermique massique de l’eau vaut 4185 SI. En faisant l’application numérique, on trouve que $ΔT$ vaut environ 14°C. Au-delà de la valeur numérique, il faut remarquer que $ΔT$ est proportionnel à $Δt$ le temps de chauffage. C’est-à-dire que si on fait chauffer deux fois plus longtemps cette masse d’eau, on aura une élévation de température deux fois plus grande. Il y a une proportionnalité entre le temps de chauffage et la variation de température du système.
