Accède gratuitement à cette vidéo pendant 7 jours
Profite de ce cours et de tout le programme de ta classe avec l'essai gratuit de 7 jours !
Fiche de cours
Électrolyse
I. Réactions d’oxydo-réductions spontanées et forcées
L’électrolyse se base sur une réaction d’oxydo-réduction. On connaît déjà les réactions d’oxydo-réductions spontanées. Par exemple, lorsqu’on place des ions Cu2+ en présence de zinc solide, on a l’apparition d’ions Zn2+ et d'un dépôt de cuivre solide.
Lorsque l'on fait une électrolyse, on fait une réaction d’oxydo-réduction forcée : on la force en apportant de l’énergie. Concrètement, on va donc essayer de faire la réaction chimique inverse, qui n’est pas spontanée, en fournissant de l’électricité.
II. Dispositif de l'électrolyse
En pratique, pour faire une électrolyse, on a ce type de dispositif :
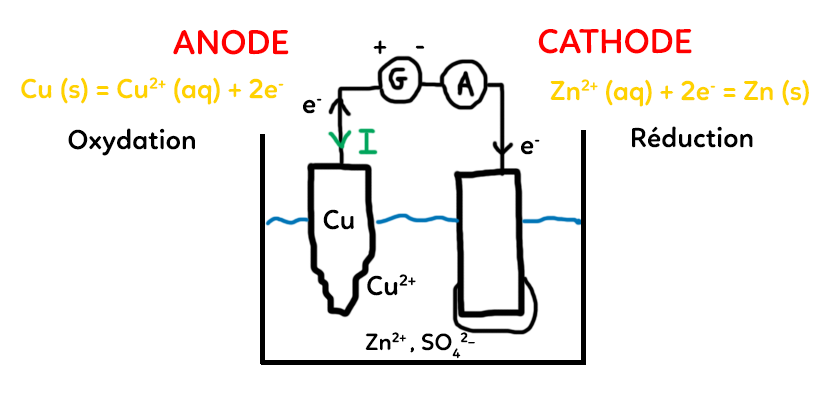
Il y a deux électrodes qui trempent dans une solution. Ces deux électrodes sont reliées à un générateur de tension qui va fournir de l
Il reste 70% de cette fiche de cours à lire
Cette fiche de cours est réservée uniquement à nos abonnés. N'attends pas pour en profiter, abonne-toi sur
lesbonsprofs.com. Tu pourras en plus accéder à l'intégralité des rappels de cours en vidéo ainsi qu'à des QCM et des exercices d'entraînement avec corrigé en texte et en vidéo.
