L'énoncé
Répondre aux questions suivantes.
Question 1
Dessiner le schéma d’une pile cuivre-zinc. Sachant que nous avons à notre disposition : une solution de sulfate de cuivre, une solution de sulfate de zinc, une lame de cuivre et une lame de zinc, des cuves et un pont salin.
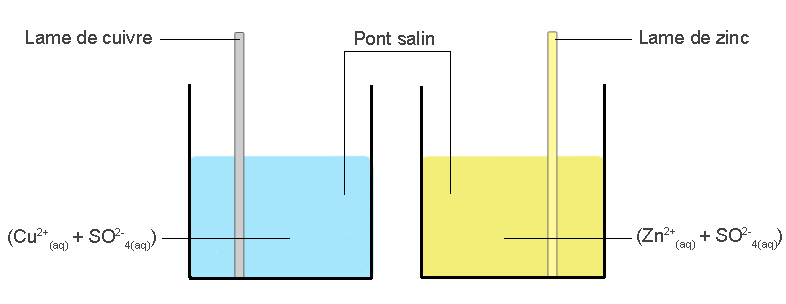
Commencez par dessiner deux cuves.
Question 2
Donner les demi-équations d’oxydo-réduction.
$Cu^{2+} + 2e^- = Cu$
$Zn = Zn^{2+} + 2e^-$
On sait que la pile est constituée de cuivre et de zinc. Il ne reste qu’à déterminer les couples associés !
Question 3
Quelle est la polarité de la pile ? Justifiez.
Selon le sens des demi-équations, on observe qu’on a :
$Cu^{2+} + 2e^- = Cu \rightarrow $ l’électrode de cuivre capte les électrons échangés.
$Zn = Zn^{2+} + 2e^- \rightarrow $ l’électrode de Zinc donne des électrons.
Alors, l’électrode de Zinc est le pôle négatif et l’électrode de cuivre le pôle positif.
On sait que le pôle négatif libère les électrons, à vous d’en déduire la suite !
