L'énoncé
Choisir la ou les bonnes réponses parmi celles proposées.
Tu as obtenu le score de
Question 1
Quelle est la formule de Lewis de la molécule $H_2O$ ?



L'hydrogène possède un doublet liant et l'oxygène possède 2 doublets liants et 2 doublets non liants.
Question 2
Quelle est la formule de Lewis de l'ion $Cl^-$ ?




D'abord il faut représenter les formule de Lewis de l'atome.
L'atome de Chlore possède 3 doublets non liants et 1 doublet liant. Lorsqu'il passe sous forme ionique, il récupère son doublet liant qui devient non liant.
Question 3
Quelle est la formule de Lewis de l'ion $HCO3^-$ ? La charge négative se trouve sur un atome d'oxygène et l'atome de carbone n'est pas lié avec l'hydrogène.



Représentez d'abord les formules de Lewis des atomes et associez les atomes ensembles en respectant les formules de Lewis.
On peut tout de suite éliminer la première réponse car le carbone est lié à l'hydrogène. Ensuite il suffit de compter le nombre de doublet liants et non liants des oxygène : l'oxygène n'a pas de charge si il possède 2 doublets liants et 2 non liants.
Question 4
Quelle est la formule de Lewis de l'ion carbonate $CO_3^{2-}$ ? Les charges ne se trouvent pas sur l'atome de carbone.



Un atome d'oxygène qui possède 3 doublets non liants et chargé d'une charge négative.
Question 5
Placer les charges sur cet ion phosphate :
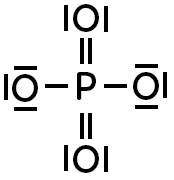
Donnée : la formule de Lewis du phosphore est :
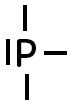




De même que précédemment. Ici, le phosphore transforme son doublet non liant pour en faire un doublet liant : il a forcément une charge positive.
