L'énoncé
Protocole 1 :
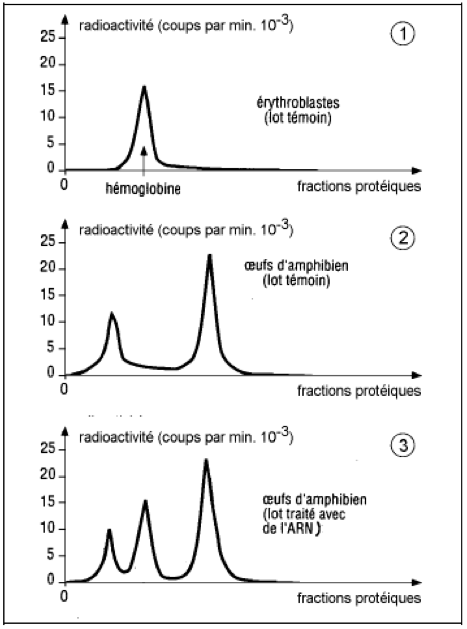
Des cellules souches* d’hématies, ou érythroblastes, sont cultivées dans un milieu contenant un acide aminé radioactif (l’histidine). Les protéines sont ensuite extraites de ces cellules et soumises à une électrophorèse*, qui montre un pic radioactif spécifique de l’hémoglobine fabriquée par ces érythroblastes.
Protocole 2 :
On cultive des œufs d’amphibiens dans un milieu présentant le même acide aminé marqué. L’électrophorèse montre alors deux pics protéiques caractérisant les protéines produites par les œufs au cours de leur incubation.
Protocole 3 :
On extrait de l’ARNm du cytoplasme des érythroblastes, et on l’injecte à des œufs d’amphibiens que l’on fait ensuite incuber dans un milieu contenant le même acide aminé marqué. On obtient alors l’électrophorèse 3.
Question 1
Quel est l’intérêt d’utiliser un acide aminé marqué radioactivement ?
Un acide aminé marqué radioactivement est repérable (par autoradiographie), donc s’il a été utilisé au cours de la synthèse d’une protéine celle-ci sera elle aussi marquée radioactivement. Cela permet donc de repérer la synthèse protéique. Les pics obtenus dans le document correspondent à des protéines radioactives, ayant intégré l’histidine radioactive fournie lors de l’expérience.
Question 2
Expliquer le but de l’expérience menée dans le protocole 1.
Dans l’expérience 1 on cultive des cellules en présence d’un acide aminé radioactif. Or on sait que les acides aminés sont les précurseurs des protéines (ils sont utilisés lors de la synthèse protéique, par traduction d’un ARNm). Le but est donc de repérer quelle protéine produisent les érythroblastes.
Question 3
Quel est le résultat obtenu et qu’en concluez-vous ?
On constate la présence d’un pic de radioactivité interprété comme de l’hémoglobine radioactive dans les protéines issues de l’érythroblaste. Ces cellules a donc produit de l’hémoglobine, en utilisant l’histidine radioactive fournie par l’expérimentateur. Cette expérience servira de témoin : on sait maintenant que les cellules souches d’hématies produisent de l’hémoglobine.
Question 4
Faire de même avec l’expérience du protocole 2.
Dans le protocole n°2 on a à nouveau fourni de l’histidine radioactive, que les cellules peuvent utiliser lors de la synthèse protéique. On constate après électrophorèse qu’il y a 2 pics de radioactivité, mais aucun ne correspond à l’hémoglobine. On détecte donc la présence de deux protéines mais d’une autre nature. Les œufs d’amphibiens ne produisent donc pas (au cours de cette expérience en tout cas) d’hémoglobine.
Question 5
Analyser le protocole 3 en utilisant les résultats déjà démontrés.
Dans le protocole n°3, on réutilise des œufs d’amphibiens mais auxquels on a injecté de l’ARNm issu du cytoplasme d’érythroblastes. On constate après électrophorèse 3 pics de radioactivité. Les œufs produisent donc 3 protéines distinctes (qui ont intégré l’histidine radioactive). Deux correspondent aux protéines identiques à celles repérées au protocole n°2.
Par ailleurs l’une de ces protéines est l’hémoglobine, puisqu’on repère son pic caractéristique, vu au protocole n°1.
Or les œufs sans injection, d’après le protocole n°2 ne produisaient pas d’hémoglobine.
Ce sont donc les ARNm injectés qui sont responsables de la synthèse d’hémoglobine.
On en déduit que l’ARNm injecté, prélevé sur les érythroblastes, était celui codant pour l’hémoglobine, et que sa traduction dans le cytoplasme des œufs de grenouille a permis la synthèse d’hémoglobine.
Les mécanismes d’expression génétique sont donc identique dans toutes les cellules : production d’ARNm (par transcription de l’ADN dans le noyau) puis synthèse protéique (par traduction de l’ARNm dans le cytoplasme).